2023年第四季度,在学院广大教师的共同努力下,科研成果产出取得了良好成效,特别是在高水平论文方面,以下我们把部分科研成果与大家分享。
让我们一起来看看吧!
01.戴建君/鞠艳敏团队设计双金属纳米酶原位催化报告分子沉积策略助力癌症诊断
侧流免疫层析法(LFIA)尽管已被应用于疾病诊断领域,但存在灵敏度和定量能力有限的缺点。研究团队使用了一种比色信号的放大策略,即双金属纳米酶介导的原位催化报告分子沉积(BN-ISCRD),用于LFIA实现了超灵敏检测癌症生物标志物。由于两种金属的协同或相加作用,双金属纳米酶表现出比单金属纳米酶更优异的类酶活性。基于此,将其作为标记材料应用于LFIA,通过原位催化报告分子沉积,实现信号放大,提高检测灵敏度。将该方法应用于检测胃癌标志物(PG I和PG II),信号放大后裸眼检测限可达10 pg/mL,灵敏度提高了200倍;同时,成功地从36个临床样本中鉴别出8个胃癌阳性样本,与临床方法的检测结果一致。这种BN-ISCRD策略将新型纳米材料与生物传感技术结合,为构建超灵敏的即时检测平台提供了一种新方法。
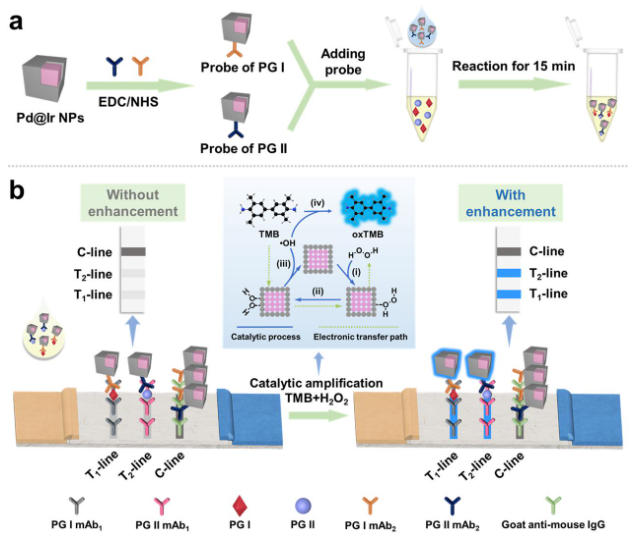
示意图:基于双金属纳米酶原位催化报告分子沉积LFIA技术的检测原理
论文信息:Meng X., Zuo W., Wu P., et al. Bimetallic Nanozyme: A Credible Tag for In Situ-Catalyzed Reporter Deposition in the Lateral Flow Immunoassay for Ultrasensitive Cancer Diagnosis.Nano Lett. 2023, https://doi.org/10.1021/acs.nanolett.3c03118
02.姜虎林教授团队在Advanced Science和Biosensors & Bioelectronics发表血液净化循环肿瘤细胞与肿瘤外泌体的医疗设备最新研究成果
肿瘤转移已成为约90 %癌症相关死亡的主要原因,而循环肿瘤细胞(CTCs)在转移过程中发挥着重要作用,所以作为无创临床诊断和预后评估的重要生物标志物,CTCs的检测和清除在预测癌症患者的总生存期和无进展生存期方面具有重要意义。然而,现有的CTCs分离和检测技术仅限于小体积的血样,不足以全面反映CTCs在全身的血行分布。受血液透析装置的启发,姜虎林教授团队开发了一种在全血中特异性清除循环肿瘤细胞的医疗设备,实现有效净化全血中的循环肿瘤细胞。
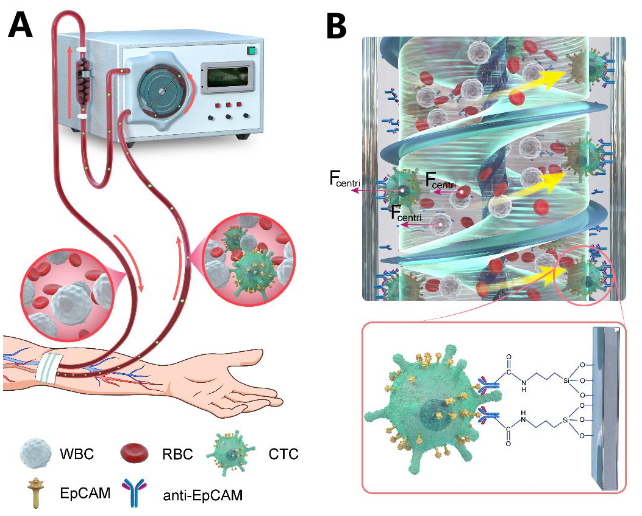
示意图:全血净化器捕获并清除CTCs
论文信息:Xing L., Wan X., Yu M., et al. A novel whole blood purifier for efficient capture and separation of circulating tumor cells. Biosens Bioelectron. 2023, https://doi.org/10.1016/j.bios.2023.115292
越来越多的证据表明,作为一种由肿瘤细胞分泌的细胞外小囊泡,肿瘤外泌体(TDEs,大小为 30-150 nm)也是导致肿瘤转移的元凶之一。姜虎林教授团队进一步开发了一种促转移衍生物净化装置(Pro-metastatic derivatives eliminator,PMDE),PMDE可以有效地捕获并清除外周血中的CTCs和TDEs,并且具有良好的生物相容性。

示意图:促转移衍生物净化装置捕获并清除CTCs和TDEs
论文信息:Sun Y., Xing L., Luo J., et al. A Pro-Metastatic Derivatives Eliminator for In Vivo Dual-Removal of Circulating Tumor Cells and Tumor-Derived Exosomes Impedes their Biodistribution into Distant Organs. Adv Sci. 2023,
https://doi.org/10.1002/advs.202304287
03.孙敏捷/周占威团队构建ATP超敏感智能递药平台“序贯”破除实体瘤多级免疫抑制屏障
肿瘤免疫治疗临床应用前景巨大。然而,实体瘤微环境组分复杂,存在多级免疫抑制屏障。截止目前,传统的治疗方式尚无法攻克上述难题,导致免疫疗效严重受限。因此,本研究创新提出:构建ATP超敏感智能递药平台,通过病灶靶标的“序贯”释药,时空可控地破除多级屏障,综合增效实体瘤免疫治疗。此项研究中,内、外部“分子桥接”可实现蛋白药物与化疗药物联合的包载与序贯逐级释放。体内外研究表明,ATP超敏感智能递药系统可通过“多米诺”序贯递送方式深入实体瘤深层,减少约44%的肿瘤相关巨噬细胞分布,显著提升肿瘤免疫治疗响应率。本研究设计的多米诺式序贯递药平台具有组装工艺简单、智能时空响应等优势,为开发肿瘤免疫治疗递药平台提供了新思路与新方法。

示意图:ATP超敏型多米诺序贯药物递送策略用于TIME的破除
论文信息:Zhang F., Dong J., Huang K., et al. “Dominolike” Barriers Elimination with an Intratumoral Adenosine-Triphosphate-Supersensitive Nanogel to Enhance Cancer Chemoimmunotherapy. ACS Nano. 2023,https://doi.org/10.1021/acsnano.3c03386
04.刘东飞团队阐明高表面活性载体实现多肽蛋白类药物高效包载作用机制
微粒制剂一直受到药物包载种类局限和载药量低等共性工程难题的制约,阻碍了其临床治疗潜力的充分发挥。有研究表明,两亲性聚合物能够显著提高多肽蛋白类药物的包载效率,然而,实现多肽蛋白类药物高效包载的作用机制仍不明晰。该团队运实验手段,结合分子动力学模拟,对两亲性聚合物抑制药物胶体颗粒相转移的作用机制进行了多层次分析。研究结果显示,具有高表面活性的两亲性聚合物不仅能在药物胶体颗粒表面形成稳定的吸附层,还能快速在油水界面自组装成致密的界面膜。通过对两亲性聚合物在整个体系中分布状态的分析,确认了游离状态是两亲性聚合物在油相中的主要存在形式。这一机制在不同种类的高表面活性载体材料及药物组成中都展现出了较高的通用性。该研究为我们理解高表面活性两亲性聚合物如何实现多肽蛋白类药物的高效包载提供了一个更为全面和深刻的视角。

示意图:两亲性聚合物实现高效包载作用机制及主要结果
论文信息:Huo Q., Gao Y., Wu W., et al. Plugging the Leak of Nanoparticles by Interfacial Polymer Adsorption Enables an Efficient Protein and Peptide Encapsulation. Adv. Funct. Mater. 2023, https://doi.org/10.1002/adfm.202310146
05.肖易倍/陈美容团队发现Argonaute介导的新型细菌免疫机制
高等真核生物的Argonaute蛋白通过核酸切割活性参与RNA沉默,抵御病毒、转座子等外来核酸入侵。相比之下Argonaute在细菌中更为多样化,然而其功能研究较少。本研究发现细菌中一类Argonaute蛋白与NAD+水解酶TIR构成一种免疫系统, 该系统本身处于自抑制状态,在Argonaute蛋白感应到入侵核酸后,该系统寡聚化而激活TIR的NAD+水解酶活性,通过大量消耗细菌NAD+抑制细菌生长防止入侵核酸增殖扩散而达到免疫的作用。该研究阐明了细菌通过偶联Argonaute蛋白的核酸识别功能和TIR水解NAD+的效应作用来抵御外来核酸入侵的分子机制,并进一步发现了参与细菌免疫的原核Argonaute在结构和功能上与之前广泛研究的真核Ago的明显区别,为今后细菌免疫机制及Argonaute的系统研究奠定了理论基础。
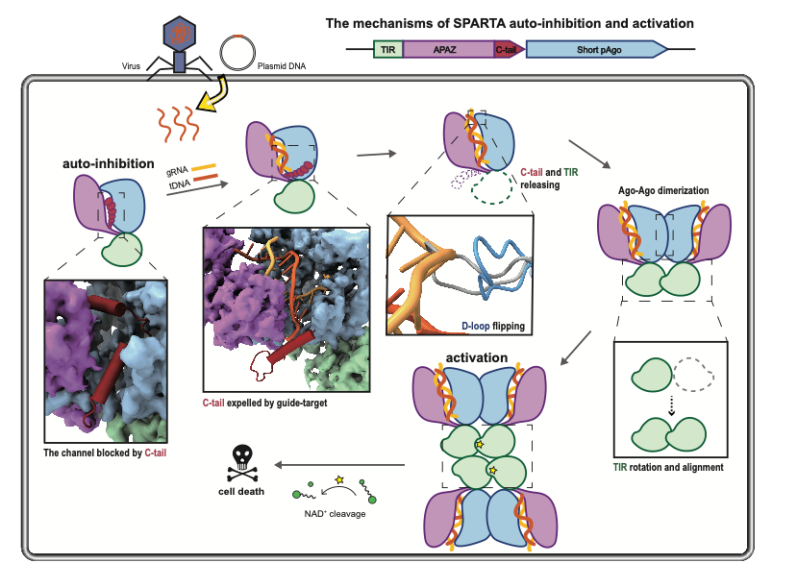
示意图
论文信息:Guo L., Huang P., Li Z., et al. Auto-inhibition and activation of a short Argonaute-associated TIR-APAZ defense system. Nat Chem Biol. 2023, https://doi.org/10.1038/s41589-023-01478-0
06.丁娅团队构建具有双层金属有机框架的酶反应器用于前药原位精准激活
丁娅团队设计和构建一类具有双层金属有机框架的酶反应器,解决酶-前药疗法中共性存在的酶和底物的精准时空调控、酶活性和催化效率的保持,以及前药原位耗竭等问题。首先,利用沸石咪唑骨架-8(ZIF-8)固定肝微粒体酶CYP450;其次,通过配体交换方法在其表面构建基于Zn-达卡巴嗪(DTIC)的外壳框架。这种特殊的核—壳结构将酶和其底物整合在同一体系中,确保其体内分布的一致性。在有效保护CYP450活性的同时,显著提高了DTIC的载药量。结果显示,该反应器仅在肿瘤细胞内高浓度烟酰胺腺嘌呤二核苷酸磷酸(NADPH)条件下发生前药激活反应,显著提高了酶催化反应的细胞选择性。该工作为体内生物催化的有效性、选择性和安全性提供了一种简单而通用的策略。

示意图:核壳结构酶-前药反应器的设计、构建和作用机理
论文信息:Wang B., Zhang S., Shen Z., et al. Core-Shell Reactor Partitioning Enzyme and Prodrug by ZIF-8 for NADPH-Sensitive In Situ Prodrug Activation. Angew. Chem.Int. Ed. 2023, https://doi.org/10.1002/anie.202314025
07.姚和权/林爱俊团队设计开发手性二环[3.2.1]辛二烯桥环骨架构建新策略
桥环化合物是众多天然产物和药物分子的核心骨架,具有独特的生物活性。然而,桥环化合物骨架刚性强,环张力大,且存在多个手性中心,使得该类骨架构建及立体选择性控制具有一定挑战性。近日,姚和权/林爱俊团队设计合成了一类含有炔基片段的环戊烯化合物,通过钯催化不对称分子内烯-炔偶联反应,高效构建了一类含有季碳和叔碳立体中心的手性二环[3.2.1]辛二烯桥环骨架。产物中的烯基和烯酮片段能够实现多种类型化学转化,极大丰富了产物结构多样性。此外,二环[3.2.1]辛二烯桥环化合物可经过碘鎓离子诱导发生1,2-酰基迁移,快速构建含有三个相邻手性立体中心的碘代二环[3.2.1]辛二烯桥环化合物。这一成果为手性桥环化合物的设计合成中提供了新策略和新思路。
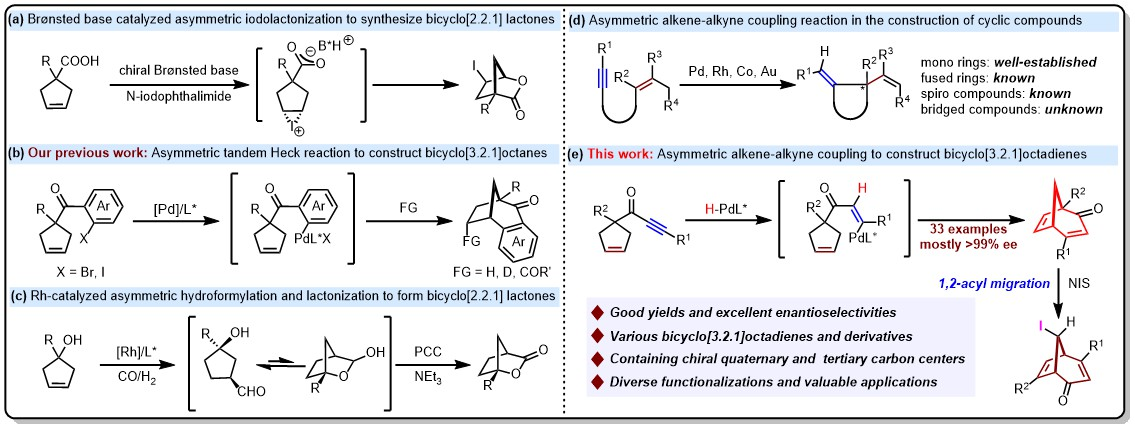
示意图
论文信息:Li Q., Li J., Zhang J., et al. Enantioselective Synthesis of Bicyclo[3.2.1]octadienes via Palladium-Catalyzed Intramolecular Alkene-Alkyne Coupling Reaction. Angew. Chem.Int. Ed. 2023, https://doi.org/10.1002/anie.202313404
08.丁娅团队构建类病毒冠状的铁—金异质纳米颗粒实现复杂生物基质的药物靶标筛选
丁娅团队设计和构建了一种类病毒冠状结构的铁—金异质纳米颗粒,实现复杂生物基质中药物靶标的筛选。为了解决传统材料如琼脂糖、磁珠和葡聚糖凝胶作为固相基质的化学蛋白质组学,在识别药物靶标时普遍存在分离速度慢、效率低、操作复杂的缺点。课题组设计和制备的铁—金异质纳米颗粒结构中的氧化铁纳米粒具备超顺磁性,有利于蛋白质的富集纯化,而位于氧化铁纳米粒表面的金颗粒可提供众多结合位点,与各种含硫醇基团的小分子和生物分子药物形成S-Au共价键,修饰于异质纳米颗粒表面,减少非特异性结合。以奥贝胆酸作为模型药物,结果验证了该异质纳米颗粒可有效用于药物的富集和靶标筛选,且类病毒冠状结构比氧化铁纳米颗粒具有更高的灵敏度和选择性。
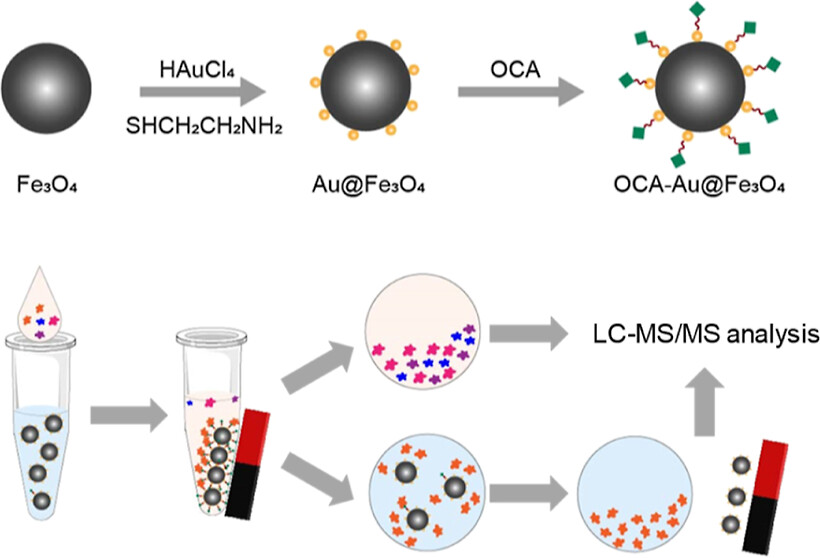
示意图:“病毒样”异质纳米颗粒用于药物靶标筛选
论文信息:Tang J., Sun Q., Xie Y., et al. Virus-like Iron-Gold Heterogeneous Nanoparticles for Drug Target Screening. Anal. Chem. 2023, https://doi.org/10.1021/acs.analchem.3c01762
09.丁杨/张华清/周建平团队设计酶沉默型纳米药物增效化疗
抗肿瘤纳米药物疗效高度取决于肿瘤部位的药物递送量,亦与瘤内药物渗透深度和滞留时间密切相关。因此,设计通过沉默肿瘤微环境降解酶的策略,延长药物瘤内渗透性和滞留性,以提升化疗药物瘤内生物利用度。该项研究报道了一种脂蛋白仿生的酶沉默型纳米海绵,该纳米海绵具有主动的细胞间层层渗透活性,瘤内渗透过程中能够可逆地释放(“呼”)/回收(“吸”)阿霉素 (DOX)。此外,纳米药物联载酶沉默小干扰RNA(siHyal1),降低以载体为底物的酶表达水平,延长纳米海绵的瘤内滞留和递药寿命,保持载体和药物肿瘤细胞层层传递过程中的时空一致性。这种创新性的肿瘤细胞间接力药物递送纳米海绵,展现了智能化的药物递送系统设计概念,显著提升了化疗药物的瘤内生物利用度和疗效。
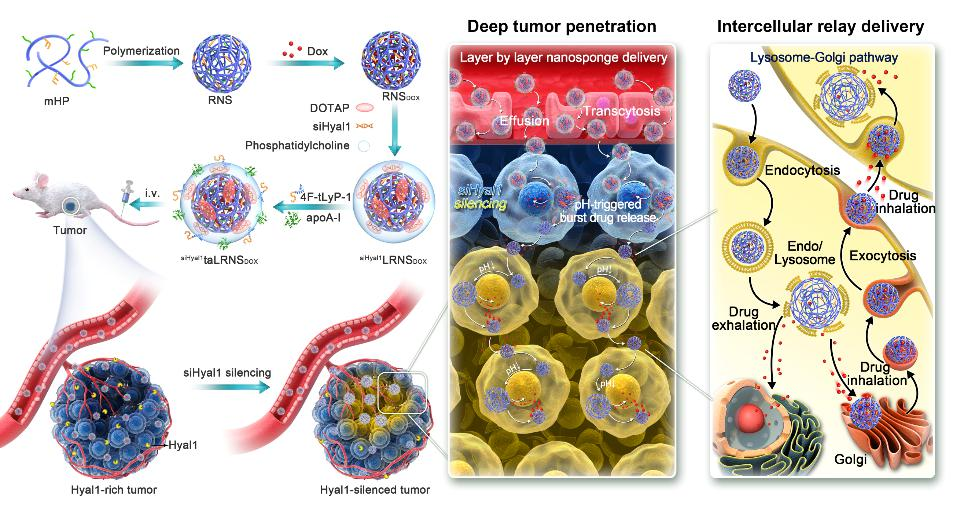
示意图
论文信息:Yang X., Zhang C., Song M., et al. Enzyme-Silenced Nanosponges Prolong Intratumoral Lifetime to Facilitate Intercellular Relay Drug Delivery and Treatment Efficacy. ACS Nano. 2023, https://doi.org/10.1021/acsnano.3c06544
10.胡庆华团队首次发现动脉粥样硬化治疗原创靶标嘌呤受体P2Y6R并确证TPP对其抑制活性
研究团队揭示了动脉粥样硬化中的新病机。研究人员基于临床样本、动脉粥样硬化动物模型和单细胞测序数据分析发现巨噬细胞P2Y6R在动脉粥样硬化病程中高表达。通过构建巨噬细胞特异性P2Y6R敲除小鼠,发现巨噬细胞P2Y6R敲除小鼠的主动脉斑块明显减少。结合转录组学测序、pull down实验、蛋白组学等实验方法揭示了P2Y6R参与动脉粥样硬化的深层机制。研究人员以P2Y6R为靶点,筛选具有P2Y6R抑制活性和巨噬细胞泡沫化抑制作用的药物,发现维生素B1的辅酶TPP具有优异的抑制活性。进一步发现TPP可减少脂质摄取,抑制巨噬细胞泡沫化的作用,减少动脉粥样硬化小鼠主动脉斑块的产生。该研究为动脉粥样硬化患者的治疗和动脉粥样硬化性心血管疾病高危患者的预防提供了新策略。
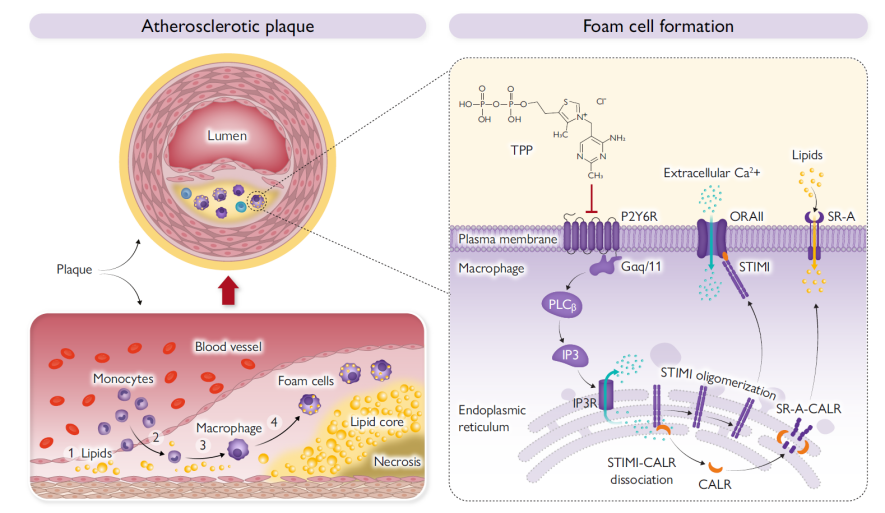
示意图:P2Y6R调控巨噬细胞泡沫化参与动脉粥样硬化
论文信息:Li Y., Zhou M., Li H., et al. Macrophage P2Y6 receptor deletion attenuates atherosclerosis by limiting foam cell formation through phospholipase Cβ/store-operated calcium entry/calreticulin/scavenger receptor A pathways. Eur Heart J. 2023, https://doi.org/10.1093/eurheartj/ehad796
11.牛淼淼/郑禄枫/徐盛涛团队发现全球首个具有前列腺癌治疗前景的微管蛋白/NRP1双靶点小分子抑制剂TN-2
该团队利用智能化双靶点先导化合物筛选平台成功发现了具有前列腺癌治疗前景的首个微管蛋白/NRP1双靶点小分子抑制剂TN-2(该化合物目前已获得专利授权:CN 116332802 B)。机制研究表明,TN-2可有效地干扰微管蛋白聚合,引起前列腺癌PC-3细胞G2/M期阻滞;还能通过抑制NRP1介导的VEGF-VEGFR2通路来抑制细胞的血管生成及转移。体内实验显示,TN-2能够显著抑制前列腺癌异种移植小鼠肿瘤生长且无明显毒副作用。

示意图
论文信息:Zheng L., Zou Y., Xie T., et al. Discovery of a Dual Tubulin and Neuropilin-1 (NRP1) Inhibitor with Potent In Vivo Anti-Tumor Activity via Pharmacophore-based Docking Screening, Structure Optimization, and Biological Evaluation. J. Med. Chem. 2023, https://doi.org/10.1021/acs.jmedchem.3c01572
12.丁杨/张华清/周建平团队开发Aβ类抗体药物经鼻治疗阿尔茨海默症
近年,FDA连续获批Aducanumab和Lecanemab两种Aβ抗体用于阿尔茨海默症(AD)早期治疗,但临床收益仍受限于Aβ中枢代谢水平低和脑出血/水肿等不良反应。丁杨/张华清/周建平团队研发了一种“Aβ类抗体药物“盘状高密度脂蛋白HDL-Disc(Aβ亲和力水平比Aducanumab高3.7倍),并与糖基促渗聚合物定向组装成polyDisc。经鼻给药后,促渗聚合物可逆开启黏膜屏障,HDL-Disc利用脑内外转运特性富集入脑,定向捕获Aβ靶向至小胶质细胞完成高效中枢清除;此外,通过淋巴外排入血富集肝脏增效外周代谢活性,实现中枢协同外周的Aβ高效代谢。本研究创新性提出了中枢协同外周Aβ系统代谢疗法,阐明了“Aβ类抗体”HDL-Disc特殊的“鼻→脑→血→肝”转运路径,增效Aβ清除的同时有效减轻中枢负荷,提高治疗安全性,为Aβ代谢依赖的AD临床治疗提供了新思路、新方案和新技术。

示意图
论文信息:Zhang H., Chen Y., Yu M., et al. Nasal delivery of polymeric nanoDisc mobilizes a synergy of central and peripheral amyloid-β clearance to treat Alzheimer’s disease. Proc Natl Acad Sci USA. 2023, https://doi.org/10.1073/pnas.2304213120
13.徐云根/朱启华/邹毅团队开发特异性激活肿瘤组织I型干扰素信号通路的吲唑甲酰胺类PARP7抑制剂
PARP7是细胞中I型干扰素通路的主要抑制因子,抑制PARP7可重新激活cGAS-STING通路介导的先天免疫,并可增强由T细胞介导的适应性免疫,提高机体的抗肿瘤免疫应答。然而,目前还尚未有PARP7抑制剂被批准上市。该团队在RBN-2397结构的基础上,采用骨架跃迁和“刚性约束”策略,设计并合成了一系列具有全新骨架的衍生物,其中,化合物(S)-XY-05对PARP7的抑制活性强(IC50: 4.5 nM),亚型选择性好;其在ICR小鼠体内的生物利用度达到94.6%。在Balb/c小鼠CT26结肠癌细胞同种移植瘤模型实验中,(S)-XY-05灌胃给药25 mg/kg的抑瘤率高达83%,显著优于RBN-2397。体内机制研究显示,(S)-XY-05提高了肿瘤组织中T细胞的募集,而脾脏组织中的T细胞基本不变,说明(S)-XY-05可特异性激活肿瘤组织内的I型干扰素信号通路,而不影响其它组织,这也是PARP7抑制剂区别于其它肿瘤免疫疗法的重要特点。
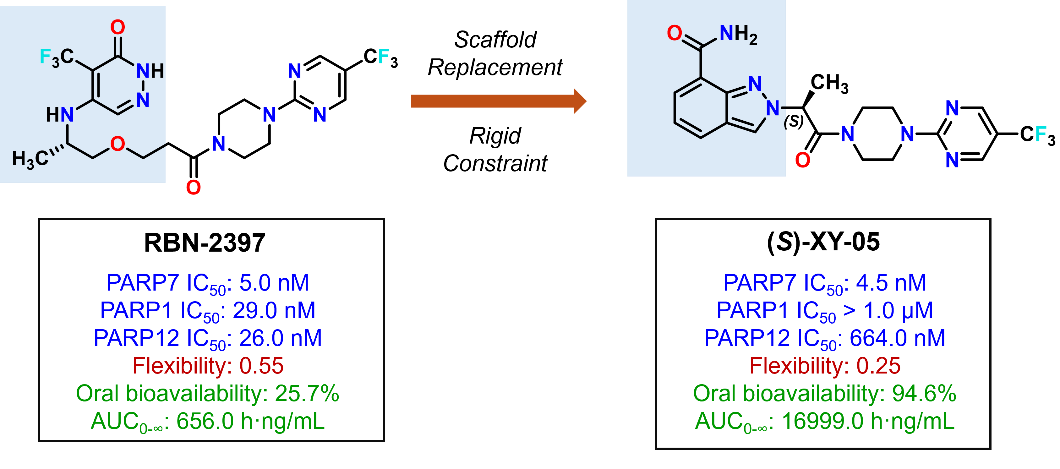
示意图
论文信息:Gu H, Yan W, Yang J, et al. Discovery of Highly Selective PARP7 Inhibitors with a Novel Scaffold for Cancer Immunotherapy. J Med Chem. 2023, doi: 10.1021/acs.jmedchem.3c01764
14.尹莉芳/辛晓斐/秦超团队构建疾病特异性蛋白冠介导的核酸药物递送平台用于银屑病治疗
银屑病患者中性粒细胞分泌的抗菌肽LL-37是诱导皮肤嗜性的抗原特异性T淋巴细胞分化、激活和病灶浸润的关键。研究团队创新性构建了乙二醇-聚组氨酸和聚乙二醇-聚乳酸的自组装纳米体系,并进一步与siRNA-TNFα和寡聚赖氨酸修饰的甲氨蝶呤前药结合形成“三明治”结构的HLNP-MNs。HLNP-MNs在静脉注射后能特异性捕获银屑病小鼠血清中的LL37及“中性粒细胞胞外陷阱”信号通路相关蛋白,高效靶向银屑病相关外周炎症免疫细胞,并降低血清中“自身抗原”的水平;同时,siRNA-TNFα与甲氨蝶呤可协同作用,精确阻断“自身抗原”诱导的银屑病复发,并最终恢复机体免疫稳态。本研究提出了通过规避或利用纳米粒与疾病特异性蛋白冠的相互作用的药物靶向递送策略,为银屑病有效治疗提供了新思路。

示意图





